点蚀研究方法--钝化曲线的测量
一、金属钝化原理
在以金属作阳极的电解池中,有电流通过时,通常会发生阳极的电化学溶解过程:M→Mn++ne-。当阳极的极化不太大时,溶解速度随着阳极电极电位(电极电位)的增大而增大,这是金属正常的阳极溶解。但在某些化学介质中,当阳极电极电位超过某一正值后,阳极的溶解速度随着阳极电极电位的增大反而大幅度地降低,这种现象称为金属的钝化。研究金属的钝化过程,需要测定钝化曲线,通常用恒电位法。
将被研究金属例如铁、镍、铬等或其合金置于硫酸或硫酸盐溶液中即为研究电极,它与辅助电极(铂电极)组成一个电解池,同时它又与参比电极(硫酸亚汞电极)组成原电池。
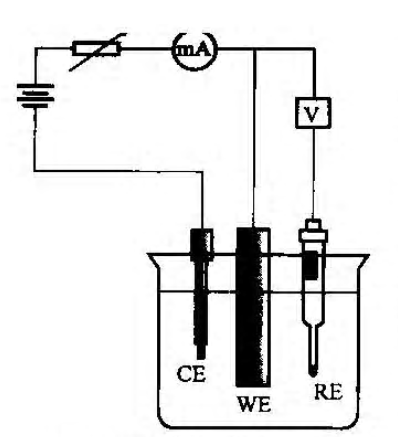
图1. 恒电位法测定金属纯化曲线
以镍作阳极为例,其基本测量线路如图1,测量回路分为两部分,一是研究电极和辅助电极形成的极化回路,由“mA”表测量极化电流的大小;二是参比电极与研究电极形成的电位测量回路。
图中WE表示研究电极,CE表示辅助电极,RE表示参比电极。参比电极与研究电极组成原电池,可确定研究电极的电位;辅助电极与研究电极组成电解池,使研究电极处于极化状态。通过恒电位仪研究电极给定一个恒定电位后,测量与之对应准稳态电流值I。以通过研究电极的电流密度i的对数lgi对超电位作图,即得到金属的钝化曲线。超电位即为电流密度为i时的阳极电极电位E(i)与i=0时的阳极电极电位之差:
图2是Fe在1.0 mol/L H2SO4溶液中的阴极极化和阳极极化曲线图。AR为阴极极化曲线,当对电极进行阴极极化时,阳极反应被抑制,阴极反应加速,电化学过程以H2析出为主。AB为阳极极化曲线,当对电极进行阳极极化时,阴极反应被抑制,阳极反应加速,电化学过程以Fe溶解为主。在一定的极化电位范围内,阳极极化和阴极极化过程以活化极化为主,因此,电极的超电位与电流之间的关系均符合Tafel方程。作两条Tafel直线IS和HS,其交点S对应的纵坐标为自腐蚀电流的对数值,可求得自腐蚀电流 Icorr,横坐标即为自腐蚀电位 Ecorr。
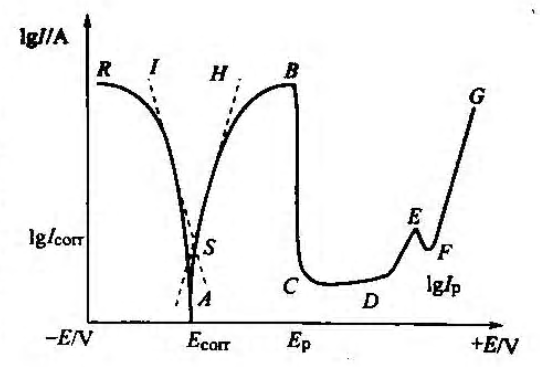
图2. 阴极极化和阳极极化曲线图
当阳极极化进一步加强,电位继续增大时,Fe 阳极极化电流缓慢增大至B点对应的电流,此时,只要极化电位稍过EB,电流直线下降,此后电位增加,电流几乎不变,此电流称为钝化电流IB,EB 称为致钝电位。图中A到B的范围称为活化区,是Fe的正常溶解;B到C的范围称为活化钝化过渡区。C到D的范围称为钝化区;D到G的范围称为过钝化区,其中D到E的范围是Fe2+转变成了Fe3+,F到G的范围有氧气析出。
处在钝化状态的金属溶解速度很小,这在金属防腐蚀及作为电镀的不溶性阳极时,正是人们所需要的。但在其他情况下,如化学电源、电冶金和电镀中的可溶性阳极,金属钝化就非常有害。金属的钝化,与金属本身性质及腐蚀介质有关。如Fe在硫酸溶液中易于钝化,若存在Cl-,不但不钝化。同理,当阴极极化进一步加强时,即电位变得更小,Fe阴极极化电流缓慢增大.在电镀工业中,为了保证镀层的质量,必须创造条件保持较大的极化度,电镀的实质是电结晶过程,为获得细致、紧密的镀层,必须控制晶核生成速率大于晶核成长速率.而形成小晶体比大晶体具有更高的表面能,因而从阴极析出小晶体就需要较高的超电压.但只考虑增加电流密度,即增加电极反应速率,就会形成疏松的镀层。因此应控制小的电极反应速率、增加电化学极化。如在电镀液中加人合适的配位剂和表面活性剂,就能增加阴极的电化学极化,使金属镀层的表面状态致密光滑,美观且防腐效果好。
二、循环极化曲线测试
使用CS电化学工作站前应详细阅读使用说明书。
(1)将三电极体系分别与电极电缆线的工作(WE)、辅助(CE)和参比(RE)电极夹相连,若有白色(SE)夹子同绿色夹子一同夹在工作电极上,然后调节电极夹的位置使电极浸人电解溶中。
(2)开启电脑、CS电化学工作站、双击桌面上的CorrTest电化学测试软件。
(3)点击“测试方法”→“稳态极化”→“开路电位”,设置文件保存路径和相关参数,点击“开始”进行开路电位测试,图形显示为电位-时间图。

图3. 开路电位测量参数设置界面
(4)开路电位稳定后,选择“测试方法”→“稳态极化”→“动电位扫描”,进行动电位扫描测试,为使Fe的阴极极化、阳极极化、钝化、过钝化全都表示出来,初始电位设为“-1.0 V”,终态电位设为“2.0 V”,均相对于开路电位;扫描速率设为“0.167 mV/s”,为避免强极化对电极的损坏,可设置当电流大于500μA时自动停止。点击“确定”后开始动电位扫描,并在屏幕显示极化曲线。

图4. 循环极化测试参数设置
考虑到用户在测量前并不知道金属的实际点蚀电位位于何处,因此可将终止电位设置值取大一些,比如:1.5、2V。尤其是对于钝性强的材料,实际扫描时,根据设定的钝化膜击穿电流 (即图4中的0.5 mA)值,扫描可能在到达终止电位之前即开始回扫。
当极化电位向正方向扫描至某一值时,钝化膜发生破裂,极化电流迅速增加,此时的极化电位称为破裂电位Eb,如图5所示。当极化电流超过某一规定值后,电位立刻转向负方向扫描,此后尽管阳极极化过电位开始减小,但由于钝化膜此时已击穿,因此阳极溶解电流并不会立刻下降,而是不断增加直到一个最大值后再开始下降,并在某一电位值与极化曲线的正向扫描段汇合,从而在图中形成一个滞后环,回扫曲线与正扫曲线的交点一般认为是材料在该介质中的保护电位Ep。随着电位的继续负移,极化电流开始由阳极转向阴极,如果在图3中设置当阴极电流<0时停止,则图5中的极化电流一旦从阳极性转为阴极性,电位立刻停止扫描,并断开极化状态,形成一个完全封闭的滞后环。
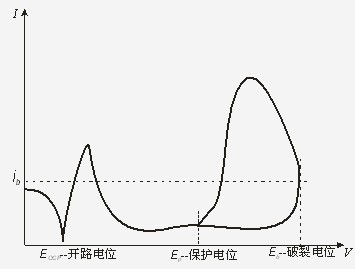
图5. 典型的钝化回扫曲线
例如:测量304不锈钢在3% NaCl溶液中的钝化曲线,可按图4中所指定的当阳极电流密度大于0.5 mA,具体数值依面积而定,一般设定回扫电流密度为0.5 mA/cm2,扫描反向。当电位继续向阴极方向扫描时,极化电流密度也会下降,并最终形成一个封闭曲线;当极化电流<0(从阳极极化变成阴极极化)时,软件自动终止极化过程。
三、测试案例
(1)电极的封装与测试
图6为某医疗器械厂提供的不锈钢骨骼固定支架,其表面采用浓硝酸预钝化处理。然后在3% NaCl溶液中进行点蚀电位测量。

图6. 支架的封装
实验前,将一根导线铰接在支架的一端,然后用透明胶带纸将两端封好,仅留出中间约1 cm宽的部位,支架的反面则全部密封,然后用703硅橡胶将胶带纸露头的位置密封好,干燥24 h后即可放入到测试溶液中进行动电位扫描。动电位极化的扫速是0.167 mV/s,极化曲线见图7和图8。显然破裂电位越正(垂直线对应电位值),则材料的耐点蚀性能越好。图8中预钝化不锈钢样品的点蚀电位Eb远高于未钝化体系,这表明在浓硝酸中的预钝化处理可明显增加不锈钢的耐点蚀能力。
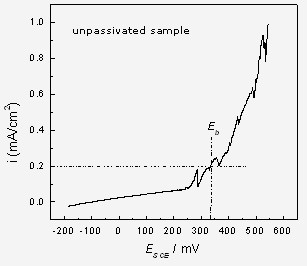
图7. 未钝化的不锈钢样品的点蚀电位为340 mV.SCE
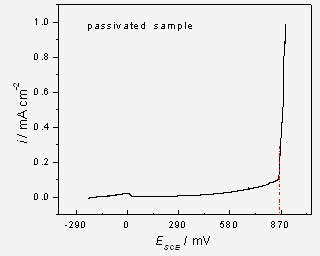
图8. 钝化了的316不锈钢的点蚀电位为850 mV.SCE
(2)缓蚀剂抑制碳钢点蚀
将碳钢试样浸泡在含有CO32-和Cl-模拟溶液中,进行动电位扫描测量,研究钢筋钝化膜在析氧之前的击穿电位Eb及其变化规律,并观察记录电极表面的点蚀形貌。动电位极化的扫速是0.334 mV/s,从相对开路电位-0.1 V扫到相对开路电位1.5 V,在模拟溶液中添加不同浓度的缓蚀剂,观察击穿电位Eb和保护电位Ep随Cl-和缓蚀剂浓度的变化规律。
(3)添加缓蚀剂Ca(NO2)2的极化曲线
在模拟混凝土孔隙液中,添加2%(w/w) Ca(NO2)2和NaCl,使Cl-含量(w/w)为0.2%或0.4%,试验前将16Mn钢电极浸入到混凝土孔溶液中,待自腐蚀电位稳定后,进行极化曲线测量,结果如图 9。
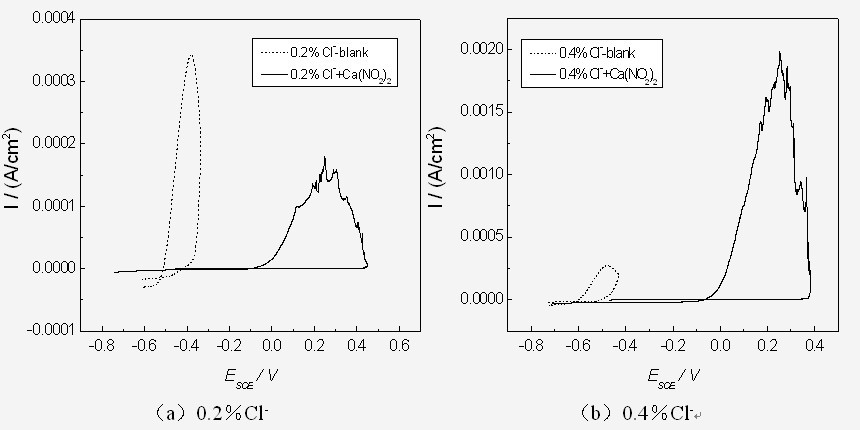
图9. 16Mn钢在含不同Cl-浓度的孔隙液中添加2% Ca(NO2)2的循环极化曲线图
从图9来看,在不含Cl-的强碱条件下,OH-能在钢筋表面形成钝化膜,在此阶段,OH-吸附在钝化膜上,并通过氧的还原反应来提供钝化膜修复所需的维钝电流。当Cl-浓度超过临界值时,Cl-就会代替部分OH-,造成钝化膜的局部破坏。阳极产物亚铁离子与阴极产物氢氧根离子结合,并进一步氧化而形成不同组成、不同颜色的松散锈层。
加入Ca(NO2)2后,Eb和Ep值均大幅增加,说明在缓蚀剂作用下,钢筋不易受到Cl-离子攻击而发生点蚀。即使发生点蚀后,NO2-也能对稳态蚀点进行修复和再钝化。从图9可以看出,随着Cl-含量增大,Eb负移,添加Ca(NO2)2后滞后环面积增大,但相对空白试样,其Eb和Ep明显正移,说明添加缓蚀剂后能显著提高16Mn钢的耐孔蚀效果。
(4)添加“LP”缓蚀剂的极化曲线
向配好的饱和的Ca(OH)2溶液中添加4%的“LN-I”缓蚀剂,使Cl-含量为0.2%,试验前将电极浸入到混凝土孔溶液中,待自腐蚀电位稳定后,进行动电位扫描,扫速是0.334 mV/s,从相对开路电位-0.1 V扫到相对开路电位1.5 V。
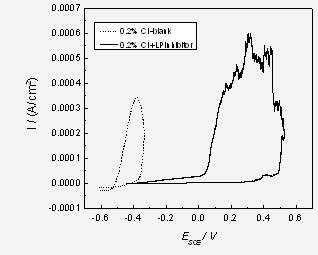
图10. 2%“LN-I”缓蚀剂对16Mn钢在含0.2% Cl-溶液中的极化曲线的影响
16Mn钢在不同Cl-浓度下添加2%“LP”缓蚀剂后极化曲线如图10所示,“LP”缓蚀剂是一种亚钙型复合缓蚀剂,添加“LP”缓蚀剂后,16Mn钢的Eb和Ep明显正移,Eb由-0.3447 V提高0.5011 V,表明该缓蚀剂的加入可明显提高钢筋耐点蚀性。
四、结论
采用动电位扫描测试用于评价金属材料的耐点蚀能力。不锈钢表面预钝化处理可以明显提高材料的点蚀电位值;加入缓蚀剂后,也可显著提高碳钢的破裂电位和保护电位。
Copyright By © 2008~2025 武汉科思特仪器股份有限公司 版权所有 鄂ICP备07502907号-1 免责声明
- 友情链接

















